東北医科薬科大学 医学部 医化学教室
Tohoku Medical and Pharmaceutical University, Division of Medicine, Department of Medical Biochemistry


研究内容
哺乳動物スフィンゴ糖脂質GM3の生理的意義の解明
スフィンゴ糖脂質とは、細胞膜外層に存在する構成脂質の一つである。疎水性部分はセラミドと呼ばれ、飽和脂肪酸を含んでいるものが多い。親水性部分は糖鎖からなり、その糖の種類と結合のバリエーションによって数百種類が合成される。スフィンゴ糖脂質の組成は組織、細胞ごとに異なり、その生理機能は様々であるが、膜タンパク質の働きを微調整するためのシグナル伝達の場(脂質マイクロドメイン)を作ることが基本的機能であると考えられる。

(1) 肺がん細胞
3LLルイス肺癌細胞では、細胞表面のスフィンゴ糖脂質の一つであるGM3の発現レベルにばらつきがあり、GM3を高発現する細胞と発現しない細胞がそれぞれ単離され、GM3高発現細胞ほど悪性度が高いことが明らかになっていた(Inokuchi JI. et al., 1993 Clin. Exp. Metastasis)。
GM3が悪性形質を規定しているのかを検証するため、GM3非発現株(J5)にGM3合成酵素遺伝子(SAT-I:St3gal5, GM3S)を導入し、GM3発現株(J5/SAT-I)を樹立した。J5/SAT-Iは親株に比べて増殖速度には変化が見られない一方、足場非依存性増殖や低血清条件でのアポトーシス抵抗性を獲得し、腫瘍悪性形質が強まっていた。分子メカニズム解析を試みた結果、J5/SAT-IではPDGFα受容体の遺伝子発現が低下していることを見出した。ただし、PDGFシグナル低下は通常、悪性形質の低下と関連することが多く、この変化が悪性化の原因なのかは現在も未解明である(Uemura S. et al., 2002 Glycobiology)。
この現象の背後には、細胞膜スフィンゴ糖脂質の組成変化がシグナル伝達や遺伝子発現を広範に制御するネットワークが潜んでいると考えられる。現在であれば、RNA-seq解析などでGM3による遺伝子発現変動を網羅的に調べることで、J5/SAT-I細胞の悪性化に関わる真の分子基盤を明らかにできる可能性がある。
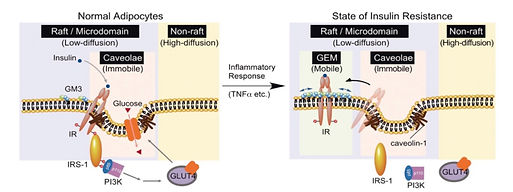
(2)脂肪細胞
肥満モデルマウス(ob/obマウス)やラット(Zucker fa/faラット)の脂肪組織を解析したところ、コントロール群と比較してGM3合成酵素遺伝子の発現が上昇し、GM3発現レベルが著明に増加していることが明らかとなった。この変化が細胞レベルでも再現されるのかを検証するため、3T3-L1細胞を脂肪細胞へ分化させ、低濃度のTNFαを作用させた。その結果、脂肪細胞は慢性炎症惹起を伴うインスリン抵抗性を示し、脂肪組織と同様にGM3発現の上昇が確認された。さらに、この細胞をGM3量を低下させる薬剤 D-PDMP(グルコシルセラミド合成酵素阻害剤)で処理すると、インスリン抵抗性が解除され、正常なインスリンシグナル伝達へと回復した(Tagami S. et al., 2007, Kabayama K. et al., 2005 and 2007)。
その後、他の研究グループによってGM3合成酵素ノックアウトマウスが作製され、同マウスでは筋組織におけるインスリン感受性が亢進していることが示された。また、in vivoでも有効なD-PDMP改良版が開発され、肥満モデルマウスでインスリン感受性の回復が報告されるなど、一時はGM3が糖尿病治療の新しい標的として大きな期待を集めた。しかし、現時点ではGM3合成を標的とした糖尿病治療薬は臨床応用に至っていない。それでも、この研究の流れは「脂質が炎症と代謝を制御する」という新たな視点を開き、代謝疾患治療の可能性を今なお刺激し続けている。